 金牌會員
金牌會員
 已認證
已認證
采用水蒸汽吸附和解吸法研究了雜化鈣鈦礦甲基銨碘化鉛(MAPI)的水化狀態。精確的水蒸汽吸附等溫線將在開發和保護MAPI器件免受濕氣損傷方面發揮重要作用。
引言
雜化鈣鈦礦甲基銨碘化鉛(CH3NH3PbI3)由于其潛在的太陽能轉化為直流電的應用裝置而引起越來越多的關注。然而,真正的挑戰在于開發在不同環境條件下工作的器件,因為MAPI可能形成一水合物(CH3NH3PbI3·H2O)或二水合物((CH3NH3)4PbI6·2H2O)晶體相,MAPI器件的電荷輸運特性取決于這些相中的甲基銨離子和水分子網絡[1]。MAPI晶體在低于40℃的水溶液中形成無色的單水合甲基銨碘化鉛(CH3NH3PbI3·H2O)。當MAPI 在Pb(NO3)2和碘化銨溶液的母液中冷卻到40℃以下時,會產生淡黃色的二水晶體。濕度的存在已被證明會顯著影響形態,并被聲稱會導致太陽能電池性能的改善。然而,水的存在也被認為可以催化MAPI的不可逆分解 變成水的HI,固體的PbI2和CH3NH2,或作為氣體釋放或溶解在水中[2]。因此,MAPI太陽能電池暴露在相對濕度大于50%的環境中會對器件性能產生迅速的不利影響。本文描述了動態蒸汽吸附可以用來檢測和表征這些水合相作為環境相對濕度的函數。
方法
動態蒸汽吸附(DVS)是一種行之有效的蒸汽吸附等溫線測定方法。用于這些研究的DVS儀器使用質量分辨率為±0.1μg的SMS超天平以重力方式測量蒸汽的吸收和損失。高質量分辨率和優良的基線穩定性使儀器能夠測量極少量探針分子的吸附和解吸。樣品周圍的蒸汽分壓通過使用電子質量流量控制器混合飽和和干燥載氣流來控制。通過將整個系統封閉在恒溫箱中,溫度保持恒定±0.1°C。
MAPI由倫敦帝國理工學院Piers等[1]使用參考文獻[3]中描述的程序制備。在DVS實驗中,將39mg 樣品放在樣品盤中,在25°C下以0%RH干燥5小 時,以去除任何殘留的水分,然后暴露在一系列階梯相對濕度(±0.5%)中。當樣品質量變化率低于~0.002% /min或~ 3 h時,實驗進入下一個RH階段。在解吸過程中,濕度增加到95%RH,然后以類似的方式降低。實驗在50°C重復進行。
結果
MAPI樣品在25℃,0 ~ 95% RH范圍內的吸濕動力學如圖1所示。紅線表示質量變化百分比(基于干值)隨時間的變化,而藍線表示相對濕度隨時間的變化。對應的等溫線如圖2所示,其中紅線沿吸附分支,藍色軌跡沿解吸分支。
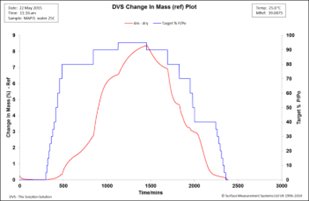
圖1. MAPI二水合物樣品在25℃時的吸水動力學
在初始干燥階段,質量損失不顯著,表明起始物料為無水形式。MAPI一水合物的分子量為637.9 amu,損失一個水分子將損失3%的重量(基于干值619.9 amu)。考慮到在初始干燥階段沒有質量損失,DVS數據表明起始樣品不處于水化狀態。從圖1可以看出,當相對濕度增加到70%以上時,吸濕率顯著增加,在95% RH時達到~8.3%。在解吸階段,樣品質量在70% RH階段下降到原始質量的3.2%。在70% ~ 50%RH之間,質量幾乎沒有變化,然后在RH = 0%時,質量下降到~ 0.2%,然后下降到0.0%,表明這是一個可逆過程。
根據下面的化學方程,我們可以計算出從MAPI到一水化合物的轉變應該導致樣品質量增加3%。
4CH3NH3PbI3+4H2O ?4[CH3NH3PbI3H2O]
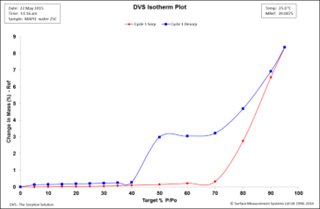
圖 2. 25°C,MAPI二水合物水吸附 (紅)和脫附(藍)等溫線
圖2中的等溫線顯示在50 RH和70% RH之間有一個寬的遲滯間隙。這通常表明水合物的形成,樣品在低RH時失去水分子,而不是獲得水分子。根據吸收量,我們可以估計水化組分的化學計量學。在50% RH的解吸步驟中,樣品在水中保留約3%的干重。利用公式1,我們可以估計這種水化物種的化學計量學:
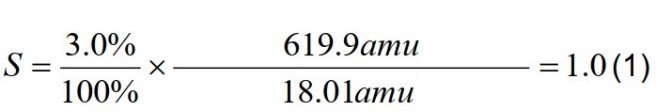
由式1可知,在解吸50%RH階段,水化組化學計量為1.0,表明為一水組分。在相為50%或60%時,吸附與解吸等溫線的吸值可取3.0%,對應于不含表面吸附貢獻的吸收率。
在60%-80%RH范圍內,MAPI樣品暴露于水蒸汽時,會占用相對大量的水,從而轉變為一水合相。在解吸階段,樣品保持一水合化學計量直到低于50%RH,再次失去一個水分子。
從圖1中可以看出,樣品在80%-90% RH階段的吸水量相對較大,此時質量急劇增加。質量吸收在90%RH步驟結束時完成,因為質量已接近平衡,樣品質量進一步增加3.5%,這對應于二水物種的形成。然而,在90%和95%RH時,樣品質量沒有達到平衡,任何水合物的形成都不會完全。在解吸階段,當濕度從90%RH降低到70%RH時,樣品質量下降3.2%,表明樣品回到了一水形態。
DVS實驗結果與理論值之間的相關性,以及Leguy等人[2]對MAPI晶體暴露在70% RH下的XRD表明,一水相在70%-50%RH之間保持穩定。然而水化狀態的變化在動力學上是有限的,長時間暴露在高%RH值下可能會導致二水合物的形成。
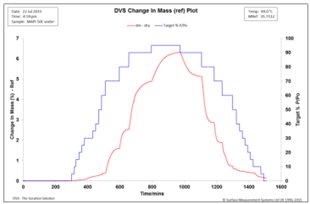
圖3. 50℃,MAPI二水合物水吸附動力學
實驗溫度為50℃,考察了溫度對水合物種類的影響。從圖3中可以看出樣品質量最初在25%RH左右時增加。然后在60%RH以上,每個濕度吸濕量都增加。然而與25℃時相應的%RH值相比,吸濕量相對較小。這是由于在更高的溫度下,分子的流動性更大,這也會導致更快的動力學。
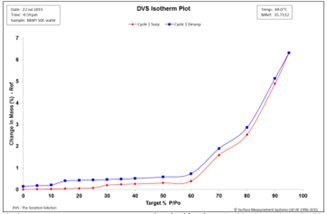
圖4. 50℃,MAPI二水合物水吸附(紅)和脫附(藍)等溫線
圖4顯示了整個%RH范圍內的遲滯回線,在0%RH時仍保持“open”狀態。相對于25°C的實驗(圖2),更小的滯后間隙證實了水化態的形成是可逆的,在50°C時動力學限制顯著減少。
結論
研究了雜化鈣鈦礦甲基銨碘化鉛(MAPI)水合物的形成和損失。水化物種的化學計量學是由兩種溫度下相對濕度的相應重量增加決定的。實驗表明在室溫下,向水化形態的可逆轉變在動力學上受到限制,從而導致材料吸水和脫水的滯后。在較高的溫度下,這種轉變發生時沒有滯后現象,而且動力學更快。先前的研究和二水化合物的直接合成及其隨后的干燥也表明恢復了原來的單水化合物和MAPI結構,證實了DVS的結果在這些反應的可逆性方面。
參考文獻
Barnes, P. R. F. et al.The hydration of organic-inorganic hybrid perovskites: theory and experiment. In press.
Leguy, A. et al. The reversible hydration of CH3NH3PbI3 in films, single crystals and solar cells. Chem. Mater. 150405140636003 (2015).
[3] Im, J.-H., Lee, C.-R., Lee, J.-W., Park, S.-W. & Park, N.-G. 6.5% Efficient Perovskite Quantum-Dot-Sensitized Solar Cell. Nanoscale 3, 4088 (2011).



